1. 이온화 경향 그리고 환원/산화 되지 않는 원소
2. 전기 분해
3. 화학 전지 - 볼타 전지
4. 화학 전지 - 다니엘 전지
1. 이온화 경향 그리고 산화/환원 되지 않는 원소
- 이온화 경향
K Ca Na Mg Al Zn Fe Ni (H) Cu Ag Au
←이온화 잘 됨 (산화가 잘됨) 이온화가 덜 됨→
- 이온화 경향이 중요한 이유:
결국 전기 분해와 화학 전지도 누가 산화 (전자를 잃고) 되고 누가 환원 (전자를 얻는지) 되는지 때문에
- 환원되지 않는 원소: 금속성이 높은 원소들
K+, Ca2+, Na+, Mg2+, Al3+, Zn+ - 산화되지 않는 원소: 비금속성이 높은 원소들
SO4 2-, CO3 2 -, NO3-, CH3COO-, F-
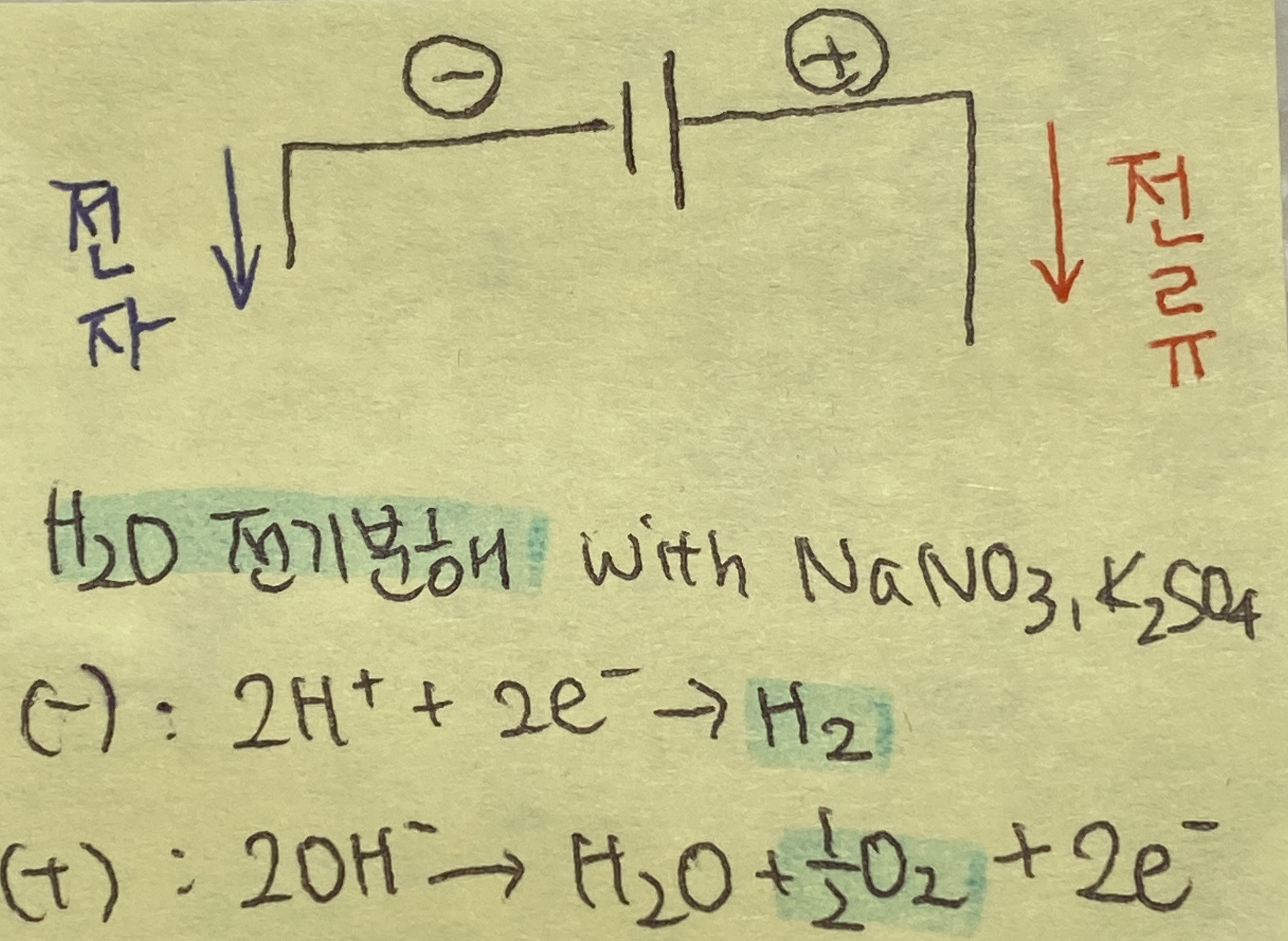
2. 전기 분해
- 기본 개념: AB → A+ + B-
- 이때 (-)극에서는 A+가 전자를 받아서 환원되고 (+)극에서는 B- 가 전자를 잃으면서 산화가 된다
- 주의할 점: 수용액과 용융액인지 잘 볼 것 (예를 들어 NaCl이면 그걸 그대로 녹인 액체 상태의 NaCl)!
수용액일때는 수소 기준으로 환원되지 않는 금속성이 높은 원소들은 수소가 대신 환원되고
산화되지 않는 원소들은 OH-가 대신 산화
예시 :
NaCl 수용액 NaCl 용융액
(-)극 : 2H+ + 2e- → H2 (-)극 : 2Na+ + 2e- → 2Na
(+)극 : 2Cl- → Cl2 + 2e- (+)극 : 2Cl- → Cl2 + 2e-
CuSO4 수용액
(-)극 : Cu2+ + 2e- → Cu
(+)극 : 2OH- → H2O + 1/2 O2 +2e-
NaNO3 수용액
(-)극 : 2H+ + 2e- → H2
(+)극 : 2OH- → H2O + 1/2 O2 +2e-
3. 화학 전지 - 볼타 전지
- 화학전지는 (-)극에서부터 (+)극 으로 전자의 흐름을 일으키는 장치
- 주의할 점!! 전자 분해랑 전자의 이동 방향이 반대임! 전자 분해는 (-)극이 환원 된다면 화학 전지는 (+)극에서 환원됨

- (-)극에서는 Zn → Zn2+ + 2e- (산화) 되면서 Zn판의 질량이 줄어듬
- (+)극에서 2H+ + 2e- → H2 (환원) 되면서 수용액의 H+농도는 줄어들고 pH는 높아지고 & 밀도도 높아진다 (H+ 대신 Zn2+가 생기면서)
- 볼타전지의 최대 단점은 분극 현상 ( 수소기체가 전자 흐름을 방해하는 현상)
- 이때 MnO2나 H2O2같은 감극제를 첨가하면 수소기체가 산화되면서 문제 해결!
4. 화학 전지 - 다니엘 전지
- 볼타 전지의 단점을 해결함! 수소 기체가 안 생겨서 분극 현상 안 일어남
- 다니엘 전지 좀 더 공부 해야함!!!
